・岡野の化学 69
講座の中から不意に出てくるワードに疑問があった場合
必ずノートに取って復習のネタにする。
今回はカルボン酸の共鳴について引っかかった。
アミノ基の非共有電子対と塩基性
アミノ酸の官能基として出てくるアミノ基NH2とカルボン酸COOH
これらは、水中ではNH3+ COO-のイオンとして存在する。
アミノ基NH2の電子に関して、
窒素Nには、原子価と言い
最外殻にある結合の手が5本存在する。
炭素Cや水素Hとの共有結合では
お互いの電子を出し合い結合する関係にあり
今回の結合の場合は、
Cに対して1個、Hに対して2個と
窒素Nの原子価は3個使う。
そこで残ったのが2個の電子。
この2個は非共有電子対(ローンペア)といって
結合の相手を持たない。
しかし、この非共有電子対があるということは
電子が余っているという状態なるので
電子を与える性質を持っている=塩基性という性質が見えてくる。
カルボン酸の共鳴について
酢酸のようなカルボン酸は、
水中で以下のように解離する。
解離とは、化学結合が分裂することで解離ともいう。
水中ではHが取れて、COO-という状態になる。
CH3COOH ⇄ CH3COO– + H+
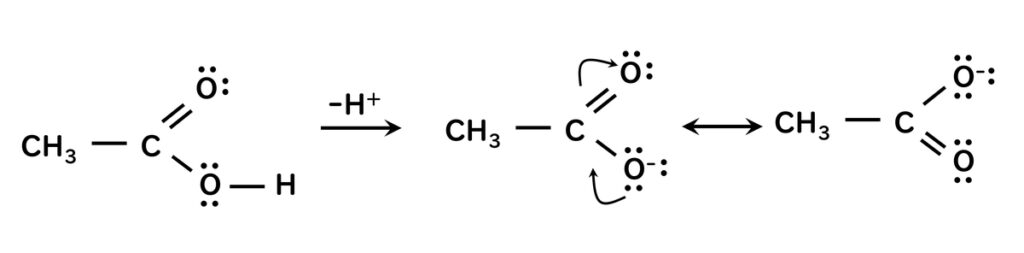
なぜ解離した酢酸イオンが安定するのか?
カルボン酸はHが分離して
COO-として存在する。
Hが取れたCは、-に分極する。
【CH3COO】–
-の電子が、C-O間に非局在化をする。
この現象を共鳴と言い、
共鳴構造を持つものは、安定化する。


コメントを残す